Loshipopotamosmorados69
perros del mal
viernes, 26 de noviembre de 2021
BINOMIOS AL CUADRADO
CONFIGURACION ELECTRONICA
¿QUE ES CONFIGURACIÓN ELECTRÓNICA?
La forma de mostrar cómo se distribuyen los electrones en un átomo es a través de la configuración electrónica. El orden en que se llenan los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de las órbitas atómicas, podemos tenerlo usando la regla diagonal, para ello debemos seguir cuidadosamente la flecha del esquema que comienza en 1s; siguiendo la flecha podemos completar las órbitas con los electrones correctamente.
Escritura de la configuración electrónica
Para escribir la configuración electrónica de un átomo es necesario:
- Conocer el número de electrones que tiene el átomo; sólo hay que conocer el número atómico (Z) del átomo en la tabla periódica. Recuerde que el número de electrones en un átomo neutro es igual al número atómico (Z = p +).
- Localiza los electrones en cada uno de los niveles de energía, empezando por el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e, p = 6e, d = 10e ef = 14e).
Ejemplos de configuración electrónica
Ejemplo: helio dos
1 es el número cuántico principal o nivel de energía (shell)
s es el subnivel o subcapa (la capacidad de subcapa es de 2 electrones)
2 muestra el número de electrones en la subcapa.
Ejemplo: Cloro 17
1s22s22s63s23p5
Coeficientes 1, 2, 2, 2, 3 y 3 niveles de energía de Cl. Como se puede ver, la “p” del subsuelo puede tener un máximo de 6 electrones.
Superíndices 2, 2, 6, 2 y 5 electrones de las capas “s” y “p”.
Ejemplo: Bromo 35
1s22s22s23p63s23p64s 2 3d104p5
Como puede ver, el sub-escudo “d” puede tener un máximo de 10 electrones.
Ejemplo: Tantalio 73
1s22s22s63s23p5
Coeficientes 1, 2, 2, 2, 3 y 3 niveles de energía de Cl. Como se puede ver, la “p” del subsuelo puede tener un máximo de 6 electrones.
Superíndices 2, 2, 6, 2 y 5 electrones de las capas “s” y “p”.
Como puede ver, la subcapa “f” puede tener un máximo de 14 electrones.
Tipos de configuración electrónica
La configuración electrónica es una representación escrita de la distribución de los electrones en un átomo, según el modelo cuántico.
En la configuración electrónica de un átomo se muestra cuántos electrones hay en cada nivel y en cada subnivel, siguiendo el orden del principio de construcción progresiva (regla de diagonales). Configuración por defecto: Se obtiene usando una caja diagonal.
Configuración condensada:
Los niveles que aparecen completos en la configuración estándar que se puede presentar con un gas noble.
Configuración desarrollada:
Consiste en representar todos los electrones de un átomo mediante flechas que simbolizan la rotación de cada uno de ellos.
Configuración semi-desarrollada:
Es una combinación entre la configuración condensada y la configuración desarrollada.
¿Qué es la configuración electrónica externa?
La configuración electrónica, también llamada estructura electrónica, es la disposición de los electrones en niveles de energía alrededor de un núcleo atómico.
Según el antiguo modelo atómico de Bohr, los electrones ocupan varios niveles en órbitas alrededor del núcleo, desde la primera capa más cercana al núcleo, K, hasta la séptima capa, Q, que es la más alejada del núcleo.
En términos de un modelo mecánico cuántico más refinado, las capas K-Q se subdividen en un conjunto de orbitales, cada uno de los cuales puede estar ocupado por no más de un par de electrones.
Comúnmente, la configuración electrónica se utiliza para describir las órbitas de un átomo en su estado fundamental, pero también puede utilizarse para representar un átomo que ha sido ionizado en un catión o anión, compensando la pérdida o ganancia de electrones en sus respectivas órbitas.
Muchas de las propiedades físicas y químicas de los elementos pueden correlacionarse con sus configuraciones electrónicas únicas. Los electrones de valencia, los electrones de la capa exterior, son el factor determinante para la química única del elemento.
Importancia de la configuración electrónica externa
Las configuraciones electrónicas juegan un papel importante en la determinación de las propiedades de los átomos.
Todos los átomos del mismo grupo tienen la misma configuración electrónica externa, excepto el número atómico n, y por lo tanto tienen propiedades químicas similares.
Algunos de los principales factores que influyen en las propiedades atómicas incluyen el tamaño de las órbitas ocupadas más grandes, la energía de las órbitas de mayor energía, el número de órbitas vagas y el número de electrones en las órbitas de mayor energía.
La mayoría de las propiedades atómicas pueden estar relacionadas con el grado de atracción entre el exterior para el núcleo y el número de electrones en la capa exterior de los electrones, el número de electrones en el electrón de valencia.
Los electrones de la capa exterior son los que son capaces de formar enlaces químicos covalentes, son los que tienen la capacidad de ionizarse para formar cationes o aniones son los que dan estado de oxidación a los elementos químicos.
También determinarán el radio atómico. Cuando n aumenta de tamaño, el rayo atómico aumenta. Cuando un átomo pierde un electrón, habrá una contracción del rayo atómico debido a la disminución de la carga negativa alrededor del núcleo.
Los electrones de la capa externa son aquellos que son considerados por el enlace de valencia, la teoría del campo cristalino y la teoría molecular orbital para obtener las propiedades de las moléculas y enlaces híbridos.
TIPOS DE PÁRRAFOS
¿Que son los párrafos?
Es una unidad, tanto lingüística como formal, de vital importancia para producir e interpretar un texto, para conocer los tipos de párrafos según su estructura lógica
¿Cuales son los tipos de párrafos ?
-Narrativo
-Descriptivo
-Argumentativo
-Párrafos de enumeración
-Párrafo de comparación
-Expositivo
¿Para que sirven cada tipo de párrafos ?
NARRATIVO:un cuento, Noticia, expone hechos en orden cronológico ( después, luego, hace 1 mes )
DESCRIPTIVO: potencia el uno de las palabras, presenta una imagen sensacional ante los lectores, receptores (delinea los objetos )
ARGUMENTATIVO : la finalidad del autor es demostrar una idea
PARRAFOS DE ENUMERACIÓN : se enumeran situaciones para ir de lo más importante a lo menos importante
PÁRRAFO DE COMPARACIÓN : compara objetos o ideas para diferenciar
EXPOSITIVO: desarrolla un tema
PROTOTIPOS TEXTUALES.
¿QUE SON LOS PROTOTIPOS TEXTUALES ?
- Las características externas. Son aqtextuales.
- Narración
- Descripción
- Exposición
- Argumentación
- Dialogo
- Narración: Cuenta de manera ordenada un suceso o historia, ya sea real o imaginaria, intervienen personajes ficticios. Los elementos que se distinguen en una narración son: narrador, personajes, tiempo y lugar. Las narraciones se presentan con una introducción, nudo o desarrollo y un deselance.
- Descripción: Informa acerca de las características detalladas de algo o alguien, es decir, como es, ha sido o sera una persona, animal u objeto, real o imaginario, ya sea de manera objetiva o subjetiva.
- Exposición: Se define por la intención para que su receptor comprenda un fenómeno o acontecimiento, presenta el resultado de un estudio, una reflexion, una investigación o un trabajo sobre un asunto o tema para que lo conozcan.
- Argumentación: Tiene como finalidad persuadir o convencer al destinatario acerca del punto de vista del emisor, utilizando una redaccion correcta, es decir, el escrito debe ser coherente, adecuado y con elementos cohesionadores.
- Dialogo: Significa intercambio comunicativo entre dos o mas hablantes, pero en un sentido estricto denota conversacion entre dos o mas personas
TABLA PERIÓDICA
¿Qué es la tabla periódica?
La tabla periódica es un esquema de todos los elementos químicos establecidos por orden de número atómico creciente y en una forma que refleja la estructura de los elementos. Los elementos están ordenados en siete hileras horizontales, llamadas específicas, y en 18 columnas verticales, llamadas grupos.
Elemento químico
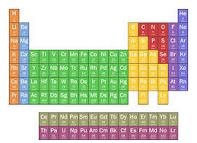 Se denomina elemento químico a una sustancia que está formada por átomos del mismo tipo cuyos núcleos presentan la misma cantidad de protones más allá del número de neutrones.
Se denomina elemento químico a una sustancia que está formada por átomos del mismo tipo cuyos núcleos presentan la misma cantidad de protones más allá del número de neutrones.
Símbolo químico
Un símbolo químico es un signo abreviado que permite reconocer un compuesto o un elemento químico, sin la necesidad de utilizar su denominación completa.
Ejemplo: El símbolo químico del oxígeno es O, el símbolo químico del hidrógeno es H y el símbolo químico del carbono es C.
Las propiedades de los elementos químicos son las características de los elementos que están relacionadas por su ubicación en la tabla periódica de acuerdo a su número atómico, conociendo sus valores tu puedes conocer sus propiedades o comportamiento químico de los elementos químicos y se denominan.
Numero atómico: es el número total de protones que tiene cada átomo de dicho elemento. Se representa con la letra Z. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente.
Masa atómica: La masa atómica es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada. La masa atómica puede ser considerada como la masa total de protones y neutrones.
Valencia: Los electrones de valencia son los electrones que se encuentran en la capa de mayor nivel de energía del átomo, siendo estos los responsables de la interacción entre átomos de distintos elementos o entre los átomos del mismo elemento, también siendo utilizados en la formación de compuestos debido a que presentan facilidad para formar enlaces.
Punto de ebullición: El punto de ebullición de un compuesto químico es la temperatura que debe alcanzar éste para pasar del estado líquido al estado gaseoso; para el proceso inverso se denomina punto de condensación
Punto de fusión: El punto de fusión es la temperatura a la cual un sólido pasa a líquido a la presión atmosférica. Durante el proceso de cambio de estado de una substancia pura, la temperatura se mantiene constante puesto que todo el calor se emplea en el proceso de fusión.
Propiedades periódicas
Electronegatividad: La electronegatividad es la fuerza, el poder de un átomo de atraer a los electrones hacia sí. También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares
Energía de ionización: mide la energía necesaria para ceder electrones y convertirse en iones positivos. La energía de ionización aumenta hacia arriba y hacia la derecha en la Tabla Periódica.
Radio atómico: El radio atómico identifica la distancia media entre dos núcleos, de un mismo elemento enlazados entre sí. Por medio del radio atómico, es posible determinar el tamaño del átomo.
NUMEROS CUANTICOS
¿Qué son los números cuánticos?
Un número cuántico es un valor que se utiliza cuando se describen los niveles de energía disponibles para los átomos y las moléculas. Un electrón en un átomo o un ion tiene cuatro números cuánticos para describir su estado y dar soluciones a la ecuación de ondas de Schrödinger para el átomo de hidrógeno. Se…Un número cuántico es un valor que se utiliza cuando se describen los niveles de energía disponibles para los átomos y las moléculas. Un electrón en un átomo o un ion tiene cuatro números cuánticos para describir su estado y dar soluciones a la ecuación de ondas de Schrödinger para el átomo de hidrógeno.
Se utilizan cuatro números cuánticos para describir completamente el movimiento y las trayectorias de cada electrón dentro de un átomo. La combinación de todos los números cuánticos de todos los electrones de un átomo se describe mediante una función de onda que cumple con la ecuación de Schrödinger.
números cuánticos
n:
Es el número cuántico denotado por n y que describe indirectamente el tamaño de la órbita de los electrones. Siempre se le asigna un valor entero (por ejemplo, n = 1, 2, 3…), pero su valor nunca puede ser 0. Un orbital para el que n = 2 es más grande, por ejemplo, que un orbital para el que n = 1. La energía debe ser absorbida para que un electrón sea excitado desde un orbital cercano al núcleo (n = 1) para llegar a un orbital más alejado del núcleo (n = 2).
El número cuántico principal se cita primero en el conjunto de cuatro números cuánticos asociados a un electrón. El número cuántico principal tiene el mayor efecto sobre la energía del electrón. Se diseñó primero para distinguir entre los diferentes niveles de energía en el modelo del átomo de Bohr, pero sigue siendo aplicable a la moderna teoría orbital atómica.
l:
El momento cuántico orbital angular número l determina la forma de un orbital, y por lo tanto la distribución angular. El número de nodos angulares es igual al valor del momento cuántico angular número l .
Cada valor de l indica una subesfera específica de s, p, d, f (cada una con una forma única.) El valor de l depende del número cuántico principal n. A diferencia de n, el valor de l puede ser cero. También puede ser un número entero positivo, pero no puede ser mayor que uno menos que el número cuántico principal (n-1):
l=0,1,2,3,4…,(n−1)
ml:
El número cuántico magnético ml determina el número de orbitales y su orientación dentro de una subcubierta. Por consiguiente, su valor depende del momento angular orbital número cuántico l. Dado un cierto l, ml es un intervalo que va de -l a +l, por lo que puede ser cero, un entero negativo o un entero positivo.
ml=−l,(−l+1),(−l+2),…,−2,−1,0,1,2,…(l–1),(l–2),+l
ms:
A diferencia de n l y ml, el número cuántico del espín de electrones ms no depende de otro número cuántico. Designa la dirección del espín del electrón y puede tener un espín de +1/2, representado por by↑, o -1/2, representado por ↓.
Esto significa que cuando ms es positivo el electrón tiene un espín ascendente, lo que puede denominarse espín arriba. Cuando es negativo, el electrón tiene un espín hacia abajo, por lo que es espín hacia abajo. La importancia del número cuántico del spin del electrón es su determinación de la capacidad de un átomo para generar un campo magnético o no.
ms=±1/2
valor de números cuánticos
no hay dos electrones en un átomo que puedan tener el mismo conjunto de números cuánticos. Cada número cuántico está representado por un valor medio o entero.
Principio de exclusión de Pauli: En 1926, Wolfgang Pauli descubrió que un conjunto de números cuánticos es específico de un determinado electrón. Es decir, no hay dos electrones que puedan tener los mismos valores para n, l, ml y ms. Aunque los tres primeros números cuánticos identifican una órbita específica y pueden tener los mismos valores, el cuarto es significativo y debe tener giros opuestos.
- El número cuántico principal es un entero que es el número de la envoltura del electrón. El valor es 1 o superior (nunca 0 o negativo).
- El número cuántico del momento angular es un número entero que es el valor del orbital del electrón (por ejemplo, s=0, p=1). ℓ es mayor o igual a cero y menor o igual a n-1.
- El número cuántico magnético es la orientación del orbital con valores enteros que van desde -ℓ a ℓ. Así, para el orbital p, donde ℓ=1, m podría tener valores de -1, 0, 1.
- El número cuántico de espín es un valor medio entero que es o bien -1/2 (llamado espín abajo) o 1/2 (llamado espín arriba).
ejemplo de un numero cuántico
Para los electrones de valencia exterior de un átomo de carbono, los electrones se encuentran en la órbita 2p. Los cuatro números cuánticos utilizados para describir los electrones son n=2, ℓ=1, m=1, 0, o -1, y s=1/2 (los electrones tienen giros paralelos).
No sólo para los electrones
Si bien los números cuánticos se utilizan comúnmente para describir los electrones, también pueden utilizarse para describir los nucleones (protones y neutrones) de un átomo o partículas elementales.
LAS CATEGORIAS GRAMATICALES
¿Qué son las categorías gramaticales?
Se refiere a una variable lingüística que puede tomar diferentes valores que condicionan la forma morfológica concreta de una palabra mucho más general que el uso tradicional del término.
Se divide en dos:
- Variable
- Invariable
Variable: Son
aquellas que presentan algún tipo de flexión de género y número. Es decir, a
estas palabras se les pueden añadir morfemas flexivos. Son las siguientes.
- Sustantivos
- Pronombres
- Verbos
- Adjetivos
- Determinantes
- Conjunciones
- Preposiciones
- Interjecciones
Tipos de categorías gramaticales
Sustantivos: Es el nombre que le damos a las cosas, las personas, los animales, etc. Es la palabra que sirve para designar a todos los seres, sean reales o imaginarios. Los sustantivos son todas las palabras que podemos utilizar para referirnos también a los objetos, ya sea material abstracto, animado o inanimado.
Clases:
- Propios e impropios
- Concretos y abstractos
- Individuales y colectivos
Adjetivo: Un adjetivo es un tipo de palabra que brinda información sobre las cualidades o elementos que caracterizan a un sustantivo, ya sea persona, lugar o cosa.
Clases:
- Calificativo
- Demostrativo
- Posesivo
- Numeral
- Indeterminado
- Interrogativo, exclamativo
Articulo: Palabra sin significado que enuncia la presencia de un sustantivo. Concuerda con él en género y número.
- El,la,los,las,lo
- Un,una,uno,unas
- Modos verbales: Indicativos, subjuntivo
- Tiempos verbales: Presente simple y continuo, pasado simple, antepresente y antepretérito, imperfecto o copretérito, futuro simple y perfecto...
- De lugar
- De modo
- De tiempo
- Cantidad
- Afirmación
- Negación
BINOMIOS AL CUADRADO
¿Que son los binomios al cuadrado ? Son aquellos que se multiplican por si mismos Ejemplos : ( a + b)2 = a2 + 2ab + b2 ( ...




